Otras lesiones específicas incluyen erupciones maculopapulares -manifestación subaguda más frecuente-, placas, nódulos o alopecia. Asimismo, las lesiones cutáneas tienen tendencia a aparecer en zonas de cicatrices y tatuajes.
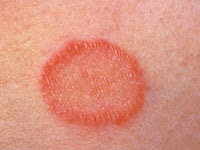
La lesión inespecífica más frecuente es el eritema nodoso (Figura 5), formando parte del síndrome de Löfgren; se trata de una paniculitis septal inespecífica que cursa con lesiones eritematosas induradas dolorosas en la región pretibial. Presenta predominio femenino, con mayor incidencia en Europa.
Sarcoidosis ocular
Su frecuencia oscila ente entre el 10 y el 80% según la etnia. En el 5% de los casos constituye la manifestación inicial. La enfermedad puede comprometer la órbita, las glándulas lagrimales, la conjuntiva y los segmentos anterior y posterior del ojo. La uveítis anterior es la afectación más frecuente (60-70%), cursando con abundantes precipitados en el endotelio corneal, nódulos iridianos, sinequias e incremento de la presión ocular. El compromiso posterior incluye: vitreítis, vasculitis, lesiones coroideas, y edema de papila moderado secundario a la presencia de granulomas.
Las complicaciones a largo plazo son comunes: pérdida de visión, glaucoma o cataratas. El examen oftalmológico completo debe ser realizado de manera sistemática en todos los pacientes con sarcoidosis, tanto para descartar la afección del órgano, como para prevenir los efectos secundarios de los fármacos utilizados para el tratamiento de la enfermedad.
El síndrome de Heerfordt-Waldenstro, es otra forma peculiar de sarcoidosis que combina uveítis, hipertrofia parotídea, parálisis facial y fiebre.
Sarcoidosis ganglionar
La afectación de los ganglios linfáticos superficiales periféricos es muy frecuente; hasta un 40% de los pacientes con sarcoidosis presentan adenopatías periféricas palpables. Habitualmente no son confluentes, no se adhieren a planos superficiales ni profundos y no son dolorosas. Los grupos ganglionares más afectados, fuera de los endotorácicos, son los cervicales, supraclaviculares, inguinales, axilares, epitrocleares y los mandibulares.
Sarcoidosis hepática y esplénica
La afectación hepática varía entre el 30 y el 80%, siendo dos veces más común en afroamericanos. La sarcoidosis hepática es a menudo asintomática, pero a veces se presenta con dolor abdominal, hepatomegalia (20% de los casos), prurito o ictericia. Raramente se complica y evoluciona a cirrosis e hipertensión portal.
La esplenomegalia se presenta en el 5-15% de los casos, pero hasta el 50% de los pacientes tienen afectación histológica asintomática. En ocasiones da lugar a un síndrome de hiperesplenismo.
Sarcoidosis del sistema nervioso
Entre el 5 y el 15% de los pacientes con sarcoidosis tienen manifestaciones neurológicas. La afección del sistema nerviosos central suele ser temprana, mientras que la del sistema nervioso periférico es más tardía. En torno al 10% de los casos son asintomáticos. El compromiso más frecuente se localiza en pares craneales (sobre todo el facial, también el nervio óptico) seguido del parénquima cerebral , meninges y médula espinal.
El compromiso del sistema nervioso se puede manifestar por distintos síntomas y signos dependiendo de la localización: parálisis, paresias, signos piramidales, síndrome meníngeo, demencia, síndrome hipotálamo-pituitario, diabetes insípida, entre otros. En muchas ocasiones, la lesión es una meningitis granulomatosa basal que comprime las estructuras adyacentes.
Cuando se sospeche de neurosarcoidosis debe realizarse una radiografía de tórax, pues hasta en un 30% de los casos se detecta enfermedad pulmonar asintomática.
La resonancia magnética (RM) es la prueba de elección para el diagnóstico de neurosarcoidosis, ya que permite observar lesiones en la sustancia blanca cerebral, engrosamiento leptomeníngeo y de los nervios craneales, hidrocefalia, etc.
En el líquido cefalorraquídeo puede encontrarse pleocitosis linfocítica, aumento de proteínas (80%), bandas oligoclonales de inmunoglobulinas (30%), aumento de la enzima convertidora de angiotensina (ECA), descenso de la glucosa y aumento del cociente CD4/CD83. El compromiso del sistema nervioso en la fase aguda de la enfermedad tiene un pronóstico favorable, mientras que la afectación crónica responde menos favorablemente.
Sarcoidosis endocrina
La hipercalcemia es una manifestación endocrinológica que puede detectarse entre un 10% y 17% en los pacientes con sarcoidosis. La hipercalciuria es tres veces más frecuente. Estas alteraciones metabólicas pueden dar lugar a nefrolitiasis, nefrocalcinosis, depósito intersticial de calcio e insuficiencia renal. Se produce porque en en el metabolismo normal de la vitamina D, la misma es primero convertida por el hígado y luego por el riñón en 1,25 dihidroxivitamina D3, metabolito que lleva a una absorción aumentada de calcio en el intestino y a una aumentada reabsorción de calcio en los huesos, mientras que en la sarcoidosis hay una síntesis no controlada de 1,25 dihidroxivitamina D3 por los macrófagos que actúan de manera independiente al mecanismo inhibitorio natural de producción de este metabolito.
El compromiso de la glándula tiroides puede manifestarse con bocio difuso o nodular con hipertiroidismo. La tiroiditis de Hashimoto con anticuerpos antitiroideos circulantes elevados, también puede verse.
Sarcoidosis cardíaca
Las manifestaciones cardíacas se presentan clínicamente en un 5% en los pacientes con sarcoidosis en comparación con las autopsias en donde la infiltración granulomatosa del miocardio puede llegar hasta un 70%.
La afección cardiaca puede ser clínicamente asintomática, o presentarse con palpitaciones -las arritmias son las manifestaciones más frecuentes-, disnea, síncope o muerte súbita. Otras manifestaciones incluyen trastornos de conducción, enfermedad valvular, fallo congestivo o arritmias ventriculares.
La inflamación granulomatosa o la fibrosis están localizadas principalmente en la pared libre del ventrículo izquierdo y el septo interventricular.
El electrocardiograma, ecocardiograma, holter de 24 h, gammagrafía con Talio 201 o Tecnecio 99, RM y la tomografía por emisión de positrones (PET) son exámenes complementarios útiles para evaluar la afectación cardiaca en la sarcoidosis, mientras que la biopsia endomiocárdica tiene baja rentabilidad diagnóstica.
Dado que la muerte súbita puede ser la forma de presentación de la afectación cardiaca, se recomienda la realización de estudios electrofisiológicos en pacientes en los que se sospeche la afectación cardiaca y eventualmente la colocación de un marcapasos o un desfibrilador automático implantable (DAI).
Sarcoidosis musculo esquelética.
Las manifestaciones musculo esqueléticas de la sarcoidosis son mas frecuentes en mujeres y en la raza afroamericana.
La artritis aguda (20%) a menudo forma parte del síndrome de Löfgren. Afecta a grandes articulaciones (tobillos, rodillas, muñecas o codos), de forma simétrica, poliarticular, poco dolorosa, migratoria y transitoria, y a menudo acompañada de eritema nodoso. La evolución es favorable y raramente deja secuelas. Es típica la inflamación periarticular de los tobillos.
La artritis crónica es poco frecuente, aparece más en pacientes afroamericanos con sarcoidosis cutánea. Sigue un curso progresivo, con erosiones articulares y deformidades. La biopsia sinovial muestra los granulomas no caseificantes.
La afectación ósea se diagnostica en el 3-13% de los pacientes. Generalmente es asintomática. La osteítis quística de Jüngling es la manifestación más común del compromiso óseo, localizada preferentemente en pequeños huesos de las manos y los pies. Clínicamente son lesiones asintomáticas y radiológicamente caracterizadas por geodas sin reacción perióstica, siendo característica la afectación bilateral de las falanges con preservación del periostio y de los márgenes corticales. A menudo se asocia con lupus pernio. La osteoesclerosis es menos frecuente.
Sarcoidosis de otros órganos
El compromiso del tracto respiratorio superior puede encontrarse en un 5-20% de los pacientes con sarcoidosis. La mucosa nasal y oral, la laringe, faringe, glándulas salivales, amígdalas y la lengua pueden estar comprometidas. El agrandamiento de la glándula parótida puede encontrarse en un 6% de los pacientes. El Síndrome de Mikuliczs corresponde a la sarcoidosis bilateral de las glándulas parótidas, submandibulares, sublinguales y lagrimales.
Además se han publicado casos de sarcoidosis afectando a cualquier órgano, incluyendo riñón, medula ósea mamas, útero, ovarios, testículos, el epidídimo y la glándula prostática.
Sarcoidosis por fármacos
Se han descrito varios fármacos potencialmente responsables del desarrollo de sarcoidosis -bloqueadores de TNF-alfa (infliximab o etanercept), interferon-alfa, interferón-beta, interferon pegilado, alemtuzumab (anticuerpo monoclonal anti-CD52), fármacos antirretrovirales y agentes quimioterápicos-. El mecanismo de acción es desconocido, pero la resolución tras el abandono de la medicación apoyan su implicación como agentes causales.
Asociación de sarcoidosis a neoplasias y otras enfermedades
La más destacada asociación entre sarcoidosis y neoplasias es el “Síndrome sarcoidosis-linfoma”, en el cual el linfoma se desarrolla 1 ó 2 años después del inicio de la sarcoidosis, siendo el linfoma de Hodgkin el más frecuente en esta asociación.
Otras asociaciones pueden encontrarse entre la sarcoidosis y tumores sólidos. Esto puede darse en pacientes que ya padecen una sarcoidosis y desarrollan un proceso oncológico, o también, en quienes ya padecen dicho proceso y subsecuentemente desarrollan una sarcoidosis. Están descriptas asociaciones con cáncer de testículo, vejiga y pulmón, ovario, estómago, melanoma, etc.
Asimismo, la sarcoidosis puede estar asociada con enfermedades autoinmunes: anemia hemolítica autoinmune; trombocitopenia idiomática autoinmune; síndrome de Sjogren; dermatomiositis/polimiositis; diabetes mellitus insulina-dependiente; colitis ulcerosa; vitiligo; tiroiditis autoinmune; dermatitis herpetiforme; lupus eritematosos sistémico; esclerodermia sistémica; artritis reumatoide; etc.
DIAGNÓSTICO
Es importante obtener una historia clínica completa con énfasis en la actividad laboral y posibles fuentes de exposición del paciente. El examen físico debe incluir una minuciosa evaluación de la piel, los pulmones, los ojos, el sistema nervioso y el corazón.
Las exploraciones complementarias deben incluir: hemograma, VSG, PCR, bioquímica con al menos función renal, hepática, proteinograma, niveles séricos de inmunoglobulina, determinación de calcio y fósforo en sangre y orina, niveles séricos de enzima convertidora de angiotensina (ECA) y sistemático de orina.
La ECA es producida normalmente por las células endoteliales del riñón, una pequeña parte por el lecho vascular pulmonar, y en la sarcoidosis, por las células epitelioides estimuladas por los linfocitos T de la periferia de los granulomas sarcoideos. Se encuentra elevada en el 75% de los pacientes no tratados, si bien la ECA no es específica para el diagnóstico de sarcoidosis y puede estar elevada en la lepra, diabetes mellitus, neumonitis por hipersensibilidad, cirrosis biliar primaria, silicosis, asbestosis, etc., los niveles muy elevados de ECA son muy sugestivos de la enfermedad. Esencialmente los niveles altos de ECA marcan la carga granulomatosa corporal total y, con mayor frecuencia, señalan la afectación pulmonar de la enfermedad.
Una radiografía simple de tórax debe realizarse y la TAC es indispensable en los casos con alta sospecha de enfermedad clínica o con eventuales complicaciones pulmonares. La Tomografía con Emisión de Positrones (PET) es un excelente método para definir zonas afectadas, así como la gammagrafía con Galio-67, que acumula el trazador en el parénquima pulmonar, específicamente en el mediastino, en las glándulas salivales, lagrimales y el bazo.
La espirometría y estudio de difusión de CO y la determinación de gases en sangre son pruebas a tener en cuenta.
El Mantoux refleja el estado de la inmunidad de tipo hipersensibilidad retardada. Es negativo en aproximadamente el 80% de los enfermos con sarcoidosis. Cabe destacar que puede negativizarse en un paciente que previamente lo presentaba positivo cuando éste desarrolla la sarcoidosis activa, volviendo a la positividad al inactivarse el proceso.
El test de Kwiem-Stilzbach es una prueba inmunológica, que al igual que otras pruebas cutáneas, mide hipersensibilidad retardada. Consiste en la inyección intradérmica de un antígeno proveniente del machacado del bazo o ganglio linfático de un enfermo con sarcoidosis activa, efectuándose su lectura entre la 4 y 6 semanas. Se considera positivo si en el sitio de la inoculación se encuentra un nódulo que en el estudio histopatológico demuestra un granuloma sarcoideo, siendo positivo en el 80% al 90% de los pacientes con la enfermedad activa. Tiene valor controvertido en aquellos pacientes con enfermedad extratorácica exclusiva. La prueba de Kviem es esencialmente una herramienta de investigación, no utilizándose en la práctica clina habitual, debido a la disponibilidad limitada y al riesgo de transmisión de la enfermedad con el reactivo.
Además, al ser la sarcoidosis una enfermedad multisistémica, si los síntomas clínicos que presente el paciente o los signos encontrados en la exploración clínica sugieren la afectación de otros órganos, estarían indicados otros estudios dirigidos. En los pacientes asintomáticos se recomienda realizar de forma rutinaria un reconocimiento oftalmológico con lámpara de hendidura, evaluación cardiaca, ECG basal y monitorización con Holter.
En la mayoría de los casos se debe considerar la posibilidad del estudio anatomopatológico. La biopsia se obtendrá del órgano afectado más accesible, generalmente pulmón, piel, adenopatías periféricas o hígado. Si el cuadro clínico radiológico es altamente compatible con sarcoidosis, para efectuar el diagnóstico es suficiente una única biopsia positiva. En cambio, si el cuadro clínico es difícil de catalogar, será conveniente obtener 2 biopsias positivas antes de efectuar el diagnóstico definitivo de sarcoidosis, debido a la poca especificidad del hallazgo de granulomas. El tipo de tejido en el que se observan los granulomas también influye en la mayor o menor especifidad para efectuar el diagnóstico de sarcoidosis. El hallazgo de granulomas en una biopsia hepática, o en una adenopatía periférica, es mucho menos específico que en una biopsia transbronquial. La fibrobroncoscopia con biopsia de un ganglio linfático transbronquial a menudo se realiza en pacientes con ausencia de compromiso cutáneo. El lavado bronquioalveolar para evaluar el recuento diferencial de leucocitos también debe realizarse. El análisis del lavado broncoalveolar muestra un aumento de linfocitos superior al 15%, con un número reducido de CD8, incremento del cociente CD4/CD8, aumento de células T activadas, CD4 e inmunoglobulinas. Un cociente CD4/CD8 superior a 3,5 tiene un valor predictivo positivo del 76% y un valor predictivo negativo del 85%.
Los granulomas están formados por macrófagos y células epitelioides rodeados por linfocitos T, con una corona externa de colágeno y fibroblastos en las formas crónicas. En ocasiones hay necrosis focal. Se puede observar gran cantidad de cuerpos de inclusión como los de Schaumann (cuerpos cálcicos), los asteroides dentro de las células multinucleadas y los de Hamazaki-Weisenberg
Criterios diagnósticos
El diagnóstico de la sarcoidosis se basa en los criterios siguientes:
- Presencia de un cuadro clínico-radiológico compatible.
- Demostración histológica de granulomas no caseificantes en uno o más órganos con tinciones y cultivos para micobacterias y hongos negativos, o un test de Kveim positivo.
- Exclusión de otras enfermedades granulomatosas.
Puede aceptarse el diagnóstico sin confirmación histológica en pacientes con un cuadro clínico compatible y al menos 2 de los criterios siguientes: radiografía de tórax en estadio I compatible, gammagrafía con galio-67 compatible, incremento del valor sérico de la enzima de conversión de la angiotensina (ECA). El diagnóstico sin confirmación histológica se aplica especialmente a pacientes con síndrome de Löfgren (ya sea con eritema nudoso o sólo con inflamación periarticular de tobillos) o a pacientes asintomáticos, a los que por otro motivo se les ha realizado una radiografía de tórax que muestra adenopatías hiliares bilaterales (estadio I). En estos casos, la benignidad de la enfermedad no justifica maniobras radicales para obtener una confirmación histológica. Sin embargo, ello implica un correcto diagnóstico diferencial y un seguimiento durante al menos 2 años, período suficiente para que pueda aparecer un diagnóstico alternativo, o hasta la completa resolución de la enfermedad. En caso de progresión de la enfermedad o de indicarse tratamiento, es conveniente obtener una confirmación histológica.
PRONÓSTICO
La sarcoidosis es, por lo general, una enfermedad relativamente benigna. La mitad de los pacientes experimenta una remisión espontánea en los tres primeros años y dos tercios en los primeros diez años. En Europa y EE. UU. la causa principal de mortalidad es la fibrosis pulmonar, en Japón, por el contrario, la causa principal de muerte es la afectación cardiaca.
Algunos factores de mal pronóstico incluyen: inicio por encima de los 40 años, raza afroamericana, duración de la enfermedad superior a 6 meses, necesidad de tratamiento con esteroides, afección multiorgánica (3 o más órganos), algunas formas de afectación extrapulmonar como la cardiaca y neurológica, excepto la parálisis facial, lupus pernio, esplenomegalia, hipercalcemia y la enfermedad ósea o articular.
También tiene mal pronóstico la sarcoidosis pulmonar cuando hay afectación parenquimatosa, hipertensión pulmonar, disnea como síntoma de presentación, alteraciones de la función pulmonar o neutrofilia en el lavado broncoalveolar.
Son factores de buen pronóstico la sarcoidosis pulmonar en estadio I, sobre todo si se asocia a eritema nodoso, ausencia de síntomas y ascendencia europea.
TRATAMIENTO
El tratamiento de primera línea son los corticoides (GC) administrados sistémicamente, prednisona oral, aunque en caso de uveítis anterior o síntomas respiratorios leves son también útiles los GC tópicos.
La dosis inicial de prednisona es de 20-40 mg/día, durante 4-8 semanas. Si no hay respuesta se mantiene la misma dosis durante 4 o 6 semanas más. La retirada del tratamiento se hará gradualmente, 5-10 mg cada 4-8 semanas, hasta llegar a 10-20 mg/día. Se pueden utilizar dosis elevadas de GC (80-100 mg /día) en pacientes con fracaso respiratorio o con afección grave cardiaca, neurológica, ocular o de las vías respiratorias altas.
La dosis de mantenimiento es de 10-20 mg/día de prednisona; en caso de recurrencia se mantendrá al menos 6-8 meses o se incrementará la dosis en 10-20 mg/día durante 2-4 semanas.
La mayoría de los pacientes pueden suspender el tratamiento al cabo de un año. Aproximadamente un tercio tendrá recurrencias, requiriendo un nuevo ciclo de tratamiento, y un pequeño porcentaje necesitará tratamiento indefinido.
El tratamiento de segunda línea incluye metotrexato, hidroxicloroquina, leflunomida, azatioprina o micofenolato, siendo de elección el metotrexato, en dosis de 10-15 mg/semana, que permite reducir la dosis de GC, aunque no parece tener otros beneficios. En casos refractarios está indicado el tratamiento con inhibidores del TNF-alfa como infliximab o adalimumab.
Algunas manifestaciones tienen un tratamiento específico: antiinflamatorios no esteroideos (AINE) o yoduro potásico para el eritema nodoso; hidroxicloroquina (400 mg/día) para la hipercalciuria y la hipercalcemia. Si hay afectación cardiaca (arritmias ventriculares, cardiomiopatía) pueden requerir de la implantación de un DAI.
Indicaciones específicas de tratamiento
Sarcoidosis pulmonar
Está indicada cuando se dan al menos dos de las siguientes circunstancias: a) síntomas pulmonares intensos; b) deterioro de la función pulmonar definido como un descenso en la capacidad pulmonar total (CPT) mayor del 10%, un descenso de la capacidad vital forzada (CVF) superior al 15%, un descenso de la capacidad de difusión (DLCO) de al menos el 20% o un descenso de la pulsioximetría en reposo o ejercicio de al menos un 4% y c) progresión de las alteraciones radiológicas.
Los pacientes en estadio I no se tratan, salvo obstrucción bronquial asociada; en estadios II y III en caso de síntomas respiratorios, alteraciones de pruebas de función pulmonar o progresión de las alteraciones radiológicas; en estadio IV la indicación de tratamiento es controvertida. Cuando coexistan la fibrosis pulmonar con focos de alveolitis activa se recomienda un ciclo de GC de 3 a 6 meses con reevaluación posterior.
Si en el estadio II y III las pruebas de función pulmonar son normales o casi normales se repetirán cada 6-12 meses.
Sarcoidosis extrapulmonar
Las indicaciones de tratamiento con corticoides sistémicos en la sarcoidosis extrapulmonar son: uveítis posterior, uveítis anterior refractaria a tratamiento tópico, afectación cardiaca, afectación del sistema nervioso central salvo parálisis facial aislada o meningitis aséptica leve, formas cutáneas graves, hiperesplenismo o afectación hepática intensa, afectación renal o hipercalcemia persistente. Se evaluará la necesidad de tratar algunos problemas del sistema nervioso como parálisis facial aislada o meningitis aséptica leve.
Criterios de respuesta
Se considera respuesta favorable cuando existe mejoría sintomática, disminución de las alteraciones radiológicas o mejoría de los parámetros funcionales (al menos incremento del 10% de CVF o CPT, del 20% en la DLCO o de 4 mm Hg de pO2, o un descenso de 4 mm Hg del gradiente alveoloarterial de oxígeno). Otros criterios de respuesta favorable son la estabilización radiológica y funcional durante un periodo de 3 a 6 meses, en pacientes con constancia de un curso progresivo previamente.
Bibliografía recomendada
- Aghajanova L, Jaffe RB, Herndon CN. Infiltrative neurosarcoidosis presenting as secondary amenorrhea: case report and review of the literature. Obstet Gynecol Surv 2013; 68:482.
- Aubart FC, Ouayoun M, Brauner M, et al. Sinonasal involvement in sarcoidosis: a case-control study of 20 patients. Medicine (Baltimore) 2006; 85:365.
- Aubry MC. Necrotizing granulomatous inflammation: what does it mean if your special stains are negative? Mod Pathol 2012; 25 Suppl 1:S31.
- Baughman RP, Lower EE, du Bois RM. Sarcoidosis. Lancet 2003; 361:1111.
- Baughman RP, Lower EE, Tami T. Upper airway. 4: Sarcoidosis of the upper respiratory tract (SURT). Thorax 2010; 65:181.
- Baughman RP, Shipley R, Eisentrout CE. Predictive value of gallium scan, angiotensin-converting enzyme level, and bronchoalveolar lavage in two-year follow-up of pulmonary sarcoidosis. Lung 1987; 165:371.
- Baughman RP, Sparkman BK, Lower EE. Six-minute walk test and health status assessment in sarcoidosis. Chest 2007; 132:207.
- Baughman RP, Teirstein AS, Judson MA, et al. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001; 164:1885.
- Birnbaum AD, French DD, Mirsaeidi M, Wehrli S. Sarcoidosis in the national veteran population: association of ocular inflammation and mortality. Ophthalmology 2015; 122:934.
- Birnie DH, Sauer WH, Bogun F, et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm 2014; 11:1305.
- Braun JJ, Gentine A, Pauli G. Sinonasal sarcoidosis: review and report of fifteen cases. Laryngoscope 2004; 114:1960.
- Brincker H. Coexistence of sarcoidosis and malignant disease: causality or coincidence? Sarcoidosis 1989; 6:31.
- Burke RR, Rybicki BA, Rao DS. Calcium and vitamin D in sarcoidosis: how to assess and manage. Semin Respir Crit Care Med 2010; 31:474.
- Chalayer É, Bachy E, Occelli P, et al. Sarcoidosis and lymphoma: a comparative study. QJM 2015; 108:871.
- Chen J, Carter R 3rd, Maoz D, et al. Breast Cancer and Sarcoidosis: Case Series and Review of the Literature. Breast Care (Basel) 2015; 10:137.
- Chevalet P, Clément R, Rodat O, et al. Sarcoidosis diagnosed in elderly subjects: retrospective study of 30 cases. Chest 2004; 126:1423.
- Cozier YC, Berman JS, Palmer JR, et al. Sarcoidosis in black women in the United States: data from the Black Women's Health Study. Chest 2011; 139:144.
- Darlington P, Gabrielsen A, Sörensson P, et al. Cardiac involvement in Caucasian patients with pulmonary sarcoidosis. Respir Res 2014; 15:15.
- De Prost N, Kerrou K, Sibony M, et al. Fluorine-18 fluorodeoxyglucose with positron emission tomography revealed bone marrow involvement in sarcoidosis patients with anaemia. Respiration 2010; 79:25.
- DiCarlo FJ Jr, DiCarlo JP, Robboy SJ, Lyons MM. Sarcoidosis of the uterus. Arch Pathol Lab Med 1989; 113:941.
- Dumas O, Abramovitz L, Wiley AS, et al. Epidemiology of Sarcoidosis in a Prospective Cohort Study of U.S. Women. Ann Am Thorac Soc 2016; 13:67.
- Evans M, Sharma O, LaBree L, et al. Differences in clinical findings between Caucasians and African Americans with biopsy-proven sarcoidosis. Ophthalmology 2007; 114:325.
- Fleischer M, Hinz A, Brähler E, et al. Factors associated with fatigue in sarcoidosis. Respir Care 2014; 59:1086.
- Grunewald J, Eklund A. Sex-specific manifestations of Löfgren's syndrome. Am J Respir Crit Care Med 2007; 175:40.
- Gungor S, Ozseker F, Yalcinsoy M, et al. Conventional markers in determination of activity of sarcoidosis. Int Immunopharmacol 2015; 25:174.
- Haas GP, Badalament R, Wonnell DM, Miles BJ. Testicular sarcoidosis: case report and review of the literature. J Urol 1986; 135:1254.
- Haramati LB, Lee G, Singh A, et al. Newly diagnosed pulmonary sarcoidosis in HIV-infected patients. Radiology 2001; 218:242.
- Herbort CP, Rao NA, Mochizuki M, members of Scientific Committee of First International Workshop on Ocular Sarcoidosis. International criteria for the diagnosis of ocular sarcoidosis: results of the first International Workshop On Ocular Sarcoidosis (IWOS). Ocul Immunol Inflamm 2009; 17:160.
- Hours S, Nunes H, Kambouchner M, et al. Pulmonary cavitary sarcoidosis: clinico-radiologic characteristics and natural history of a rare form of sarcoidosis. Medicine (Baltimore) 2008; 87:142.
- Huggins JT, Doelken P, Sahn SA, et al. Pleural effusions in a series of 181 outpatients with sarcoidosis. Chest 2006; 129:1599.
- Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med 2007; 357:2153.
- James DG, Sharma OP. Parotid gland sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2000; 17:27.
- James JC, Simpson CB. Treatment of laryngeal sarcoidosis with CO2 laser and mitomycin-C. Otolaryngol Head Neck Surg 2004; 130:262.
- Jamilloux Y, Kodjikian L, Broussolle C, Sève P. Sarcoidosis and uveitis. Autoimmun Rev 2014; 13:840.
- Judson MA, Baughman RP, Teirstein AS, et al. Defining organ involvement in sarcoidosis: the ACCESS proposed instrument. ACCESS Research Group. A Case Control Etiologic Study of Sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 1999; 16:75.
- Judson MA, Boan AD, Lackland DT. The clinical course of sarcoidosis: presentation, diagnosis, and treatment in a large white and black cohort in the United States. Sarcoidosis Vasc Diffuse Lung Dis 2012; 29:119.
- Judson MA. The diagnosis of sarcoidosis. Clin Chest Med 2008; 29:415.
- Kaira K, Oriuchi N, Otani Y, et al. Diagnostic usefulness of fluorine-18-alpha-methyltyrosine positron emission tomography in combination with 18F-fluorodeoxyglucose in sarcoidosis patients. Chest 2007; 131:1019.
- Kellner H, Späthling S, Herzer P. Ultrasound findings in Löfgren's syndrome: is ankle swelling caused by arthritis, tenosynovitis or periarthritis? J Rheumatol 1992; 19:38.
- Kirsten AM, Watz H, Kirsten D. Sarcoidosis with involvement of the paranasal sinuses - a retrospective analysis of 12 biopsy-proven cases. BMC Pulm Med 2013; 13:59.
- Knopf A, Lahmer T, Chaker A, et al. Head and neck sarcoidosis, from wait and see to tumor necrosis factor alpha therapy: a pilot study. Head Neck 2013; 35:715.
- Koyama T, Ueda H, Togashi K, et al. Radiologic manifestations of sarcoidosis in various organs. Radiographics 2004; 24:87.
- Kron J, Ellenbogen KA. Cardiac sarcoidosis: contemporary review. J Cardiovasc Electrophysiol 2015; 26:104.
- Lawson W, Jiang N, Cheng J. Sinonasal sarcoidosis: A new system of classification acting as a guide to diagnosis and treatment. Am J Rhinol Allergy 2014; 28:317.
- Lin YH, Haslam PL, Turner-Warwick M. Chronic pulmonary sarcoidosis: relationship between lung lavage cell counts, chest radiograph, and results of standard lung function tests. Thorax 1985; 40:501.
- Ma Y, Gal A, Koss MN. The pathology of pulmonary sarcoidosis: update. Semin Diagn Pathol 2007; 24:150.
- Madaule S, Lauque D, Sailler L, et al. [Splenomegaly in sarcoidosis: clinical features and outcome. Analysis of 17 cases]. Rev Med Interne 2004; 25:348.
- Mañá J. Diagnóstico y tratamiento de la sarcoidosis. Jano 2007; 1.650: 25
- Mavrikakis I, Rootman J. Diverse clinical presentations of orbital sarcoid. Am J Ophthalmol 2007; 144:769.
- McLaughlin RB, Spiegel JR, Selber J, et al. Laryngeal sarcoidosis presenting as an isolated submucosal vocal fold mass. J Voice 1999; 13:240.
- Menzin AW, You TT, Deger RB, et al. Sarcoidosis in a uterine leiomyoma. Int J Gynaecol Obstet 1995; 48:79.
- Meyer KC, Raghu G, Baughman RP, et al. An official American Thoracic Society clinical practice guideline: the clinical utility of bronchoalveolar lavage cellular analysis in interstitial lung disease. Am J Respir Crit Care Med 2012; 185:1004.
- Milman N, Hoffmann AL. Childhood sarcoidosis: long-term follow-up. Eur Respir J 2008; 31:592.
- Morimoto T, Azuma A, Abe S, et al. Epidemiology of sarcoidosis in Japan. Eur Respir J 2008; 31:372.
- Mukhopadhyay S, Wilcox BE, Myers JL, et al. Pulmonary necrotizing granulomas of unknown cause: clinical and pathologic analysis of 131 patients with completely resected nodules. Chest 2013; 144:813.
- Murialdo G, Tamagno G. Endocrine aspects of neurosarcoidosis. J Endocrinol Invest 2002; 25:650.
- Nathan N, Marcelo P, Houdouin V, et al. Lung sarcoidosis in children: update on disease expression and management. Thorax 2015; 70:537.
- Navaneethan SD, Venkatesh S, Shrivastava R, et al. Recurrent pleural and pericardial effusions due to sarcoidosis. PLoS Med 2005; 2:e63.
- Neville E, Walker AN, James DG. Prognostic factors predicting the outcome of sarcoidosis: an analysis of 818 patients. Q J Med 1983; 52:525.
- Newman LS, Rose CS, Maier LA. Sarcoidosis. N Engl J Med 1997; 336:1224.
- Newman TG, Minkowitz S, Hanna A, et al. Coexistent sarcoidosis and HIV infection. A comparison of bronchoalveolar and peripheral blood lymphocytes. Chest 1992; 102:1899.
- Ohara K, Judson MA, Baughman RP. Clincial aspects of ocular sarcoidosis. In: European Respiratory Monograph, ERS Journals, Ltd, 2005. p.188.
- O'Regan A, Berman JS. Sarcoidosis. Ann Intern Med 2012; 156:ITC5.
- Paparel P, Devonec M, Perrin P, et al. Association between sarcoidosis and testicular carcinoma: a diagnostic pitfall. Sarcoidosis Vasc Diffuse Lung Dis 2007; 24:95.
- Patel S. Ocular sarcoidosis. Int Ophthalmol Clin 2015; 55:15.
- Perez RL, Kimani AP, King TE Jr, et al. Bronchoalveolar lavage fluid D dimer levels are higher and more prevalent in black patients with pulmonary sarcoidosis. Respiration 2007; 74:297.
- Petropoulos IK, Zuber JP, Guex-Crosier Y. Heerfordt syndrome with unilateral facial nerve palsy: a rare presentation of sarcoidosis. Klin Monbl Augenheilkd 2008; 225:453.
- Porter N, Beynon HL, Randeva HS. Endocrine and reproductive manifestations of sarcoidosis. QJM 2003; 96:553.
- Renston JP, Goldman ES, Hsu RM, Tomashefski JF Jr. Peripheral blood eosinophilia in association with sarcoidosis. Mayo Clin Proc 2000; 75:586.
- Riancho-Zarrabeitia L, Martínez-Meñaca A y González-Gaya MA. Sarcoidosis. Medicine. 2013;11:2076
- Rizzato G, Palmieri G, Agrati AM, Zanussi C. The organ-specific extrapulmonary presentation of sarcoidosis: a frequent occurrence but a challenge to an early diagnosis. A 3-year-long prospective observational study. Sarcoidosis Vasc Diffuse Lung Dis 2004; 21:119.
- Rizzato G, Tinelli C. Unusual presentation of sarcoidosis. Respiration 2005; 72:3.
- Roberts SD, Mirowski GW, Wilkes D, et al. Sarcoidosis. Part II: extrapulmonary and systemic manifestations. J Am Acad Dermatol 2004; 51:628.
- Rottoli P, Bargagli E, Chidichimo C, et al. Sarcoidosis with upper respiratory tract involvement. Respir Med 2006; 100:253.
- Rybicki BA, Iannuzzi MC, Frederick MM, et al. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS). Am J Respir Crit Care Med 2001; 164:2085.
- Salazar A, Mañá J, Corbella X, et al. Splenomegaly in sarcoidosis: a report of 16 cases. Sarcoidosis 1995; 12:131.
- Sekhri A, Palaniswamy C, Kurmayagari K, et al. Interstitial lung disease associated with azacitidine use: a case report. Am J Ther 2012; 19:e98.
- Selroos O. Sarcoidosis and pregnancy: a review with results of a retrospective survey. J Intern Med 1990; 227:221.
- Semenzato C, Facco M, Agostini C. Immunologic events in the pathogenesis of interstitial lung disease: the paradigm of sarcoidosis. In: Interstitial Lung Disease, 5th, Schwarz, MI, King, TE JR (Eds), People's Medical Publishing House, Shelton, CT 2011. p.407.
- Sharma OP, Vucinic V, James DG. Splenectomy in sarcoidosis: indications, complications, and long-term follow-up. Sarcoidosis Vasc Diffuse Lung Dis 2002; 19:66.
- Soskel NT, Sharma OP. Pleural involvement in sarcoidosis. Curr Opin Pulm Med 2000; 6:455.
- Spagnolo P, Cullinan P, du Bois RM. Sarcoidosis. In: Interstitial Lung Disease, 5th, Schwarz MI, King TE Jr. (Eds), People's Medical Publishing House, Shelton, CT 2011. p.433.
- Sprague R, Harper P, McClain S, et al. Disseminated gastrointestinal sarcoidosis. Case report and review of the literature. Gastroenterology 1984; 87:421.
- Spruit MA, Thomeer MJ, Gosselink R, et al. Skeletal muscle weakness in patients with sarcoidosis and its relationship with exercise intolerance and reduced health status. Thorax 2005; 60:32.
- Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med 1999; 160:736.
- Sulavik SB, Spencer RP, Palestro CJ, et al. Specificity and sensitivity of distinctive chest radiographic and/or 67Ga images in the noninvasive diagnosis of sarcoidosis. Chest 1993; 103:403.
- Sweiss NJ, Barnathan ES, Lo K, et al. C-reactive protein predicts response to infliximab in patients with chronic sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2010; 27:49.
- Teirstein AS, Machac J, Almeida O, et al. Results of 188 whole-body fluorodeoxyglucose positron emission tomography scans in 137 patients with sarcoidosis. Chest 2007; 132:1949.
- Thomas KW, Hunninghake GW. Sarcoidosis. JAMA 2003; 289:3300.
- Toner GC, Bosl GJ. Sarcoidosis, "Sarcoid-like lymphadenopathy," and testicular germ cell tumors. Am J Med 1990; 89:651.
- Ungprasert P, Carmona EM, Crowson CS, Matteson EL. Diagnostic Utility of Angiotensin-Converting Enzyme in Sarcoidosis: A Population-Based Study. Lung 2016; 194:91.
- Ungprasert P, Carmona EM, Utz JP, et al. Epidemiology of Sarcoidosis 1946-2013: A Population-Based Study. Mayo Clin Proc 2016; 91:183.
- Vagal AS, Shipley R, Meyer CA. Radiological manifestations of sarcoidosis. Clin Dermatol 2007; 25:312.
- Vailati A, Marena C, Aristia L, et al. Sarcoidosis of the thyroid: report of a case and a review of the literature. Sarcoidosis 1993; 10:66.
- Ward K, O'Connor C, Odlum C, Fitzgerald MX. Prognostic value of bronchoalveolar lavage in sarcoidosis: the critical influence of disease presentation. Thorax 1989; 44:6.
- Warshauer DM, Dumbleton SA, Molina PL, et al. Abdominal CT findings in sarcoidosis: radiologic and clinical correlation. Radiology 1994; 192:93.
- Warshauer DM, Lee JK. Imaging manifestations of abdominal sarcoidosis. AJR Am J Roentgenol 2004; 182:15.
- Warshawsky ME, Shanies HM, Rozo A. Sarcoidosis involving the thyroid and pleura. Sarcoidosis Vasc Diffuse Lung Dis 1997; 14:165.
- Wildner D, Boxberger F, Wein A, et al. Granulomatous lung disease requiring mechanical ventilation induced by a single application of oxaliplatin-based chemotherapy for colorectal cancer: a case report. Case Rep Oncol Med 2013; 2013:683948.
- Winterbauer RH, Lammert J, Selland M, et al. Bronchoalveolar lavage cell populations in the diagnosis of sarcoidosis. Chest 1993; 104:352.
- Yanardağ H, Pamuk GE, Karayel T, Demirci S. Bone marrow involvement in sarcoidosis: an analysis of 50 bone marrow samples. Haematologia (Budap) 2002; 32:419.







Gracias por la publicación es muy interesante.
ResponderEliminarUn saludo